元达科普丨后生元作为治疗阿尔茨海默症的工具(对分子途径和神经保护作用的见解)
 2025-04-14 10:26:20
2025-04-14 10:26:20
 浏览量: 835
浏览量: 835  作者:元达生物
作者:元达生物
 2025-04-14 10:26:20
2025-04-14 10:26:20
 作者:元达生物
作者:元达生物

近日,国际著名学术期刊《Ageing Research Reviews》在线发表了综述文章《后生元作为治疗阿尔茨海默症的工具:对分子途径和神经保护作用的见解》,文章探讨了后生元对阿尔茨海默症(AD)的保护机制。后生元是由灭活益生菌及其无生命形式的代谢物组成,如维生素、肽聚糖、多糖和生物表面活性剂,对宿主生理具有重要调节作用。近年来,越来越多的证据表明,后生元通过调节与AD病理相关的多种分子通路(氧化应激、线粒体功能障碍、促炎细胞因子释放、神经元兴奋性毒性、突触传递和神经炎症)发挥作用,已成为当前治疗AD的一种新的途径。
阿尔茨海默病(AD)是一种不可逆的神经退行性疾病,影响大脑皮层和海马体等几个敏感大脑区域,导致记忆力逐渐下降、注意力缺陷、认知障碍、推理和语言问题。它关键的几个病理特征包括细胞外积聚的淀粉样蛋白β (Aβ)、tau蛋白的过度磷酸化导致细胞内神经原纤维缠结(nft)的形成、胆碱能缺陷、氧化应激和神经炎症。目前上市的药物,如乙酰胆碱酯酶(AChE)抑制剂和美金刚,旨在仅提供症状缓解,但不能改善疾病进展。
在过去的几十年里,有大量证据表明肠道健康与宿主生理存在动态联系,并强调其对神经系统疾病(如阿尔茨海默病(AD))的影响更大。临床前期和临床研究发现肠道菌群(GM)组成改变对产生有毒、错误折叠的突触蛋白的影响,这些蛋白可导致可塑性、认知障碍和细胞功能障碍。文章得出结论,靶向GM的疗法正在成为一种有前途的替代方案,可能为缓解或预防AD进展提供新的途径。
修复肠道菌群失衡的主要方法是补充营养素、使用抗菌剂、益生元及益生菌,但它们并不能预防抗生素耐药性的产生。后生元是一种极具潜力的方法,它们通过各种细胞机制发挥积极作用。后生元能够刺激免疫调节,并改善阿尔茨海默病患者的认知功能和神经元健康。后生元可以防止促炎细胞因子的合成,从而在AD的发展过程中增加对神经炎症的抑制。此外,乳酸菌来源的后生元对Aβ蛋白的溶解和乙酰胆碱酯酶的抑制具有显著效果,而乙酰胆碱酯酶对认知功能至关重要。而且,它们可能促进肠脑轴,刺激神经递质的合成,并有助于大脑的整体健康。这些机制确立了后生元在控制阿尔茨海默病进展方面的治疗潜力。
肠道菌群失调对阿尔茨海默病的影响
后生元具有调节GM以及随后调节肠脑轴的潜力,在健康的肠脑轴中,肠道与大脑之间通过迷走神经进行交流,以促进神经可塑性和兴奋性。儿茶酚胺类物质如去甲肾上腺素(NE)通过调节星形胶质细胞和小胶质细胞,促进抗炎环境并为神经元提供神经营养支持,从而维持神经保护和稳态。另一方面,AD中的肠道菌群失调导致神经递质信号传导改变和肠上皮完整性降低。这种改变导致迷走神经功能障碍,阻碍了肠脑连接,并引起大脑中的神经炎症。肠道屏障的损伤允许有毒物质进入血液,如老年斑和脂多糖(LPS)。这些毒素通过血脑屏障的渗透加剧神经炎症并释放炎症标志物。激活的小胶质细胞释放多种促炎细胞因子,包括TNF-α和IL-1β,但脑源性神经营养因子(BDNF)的减少损害了神经元的存活和可塑性。由于确保的神经炎症和神经损伤,AD进展更快,这也导致神经元死亡和认知丧失。图1展示了肠脑轴在AD发病机制中的关键作用。
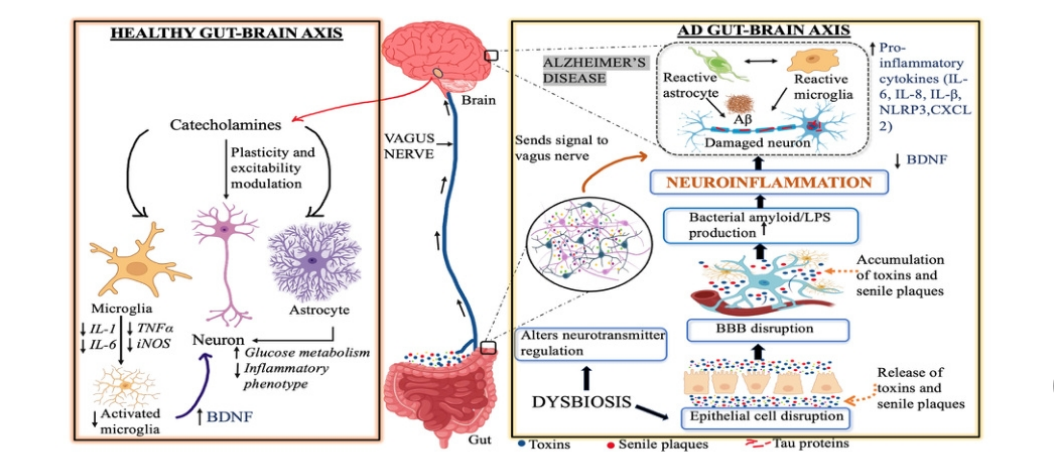
图1 肠道菌群失调在正常生理和AD病理生理中的相互作用
后生元在阿尔茨海默症中的作用机制
一、后生元在氧化应激和线粒体功能障碍中的作用机制
如图2所示,后生元可以螯合锌和铜等金属离子,从而防止金属诱导的氧化损伤。丁酸盐和丙酸盐等后生元,具有抗氧化特性,可以降低大脑中氧化应激的标志物,如丙二醛(MDA)。这些化合物降低ROS水平,从而增强抗氧化作用,防止神经元氧化损伤。后生元的免疫调节作用导致促炎细胞因子如IL-6和TNF-α的抑制,防止大脑免疫细胞的过度激活,进而从体内适当移除受损的神经元。此外,它们还可以提高内源性抗氧化物质的水平,如超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶,防止神经元细胞氧化应激。
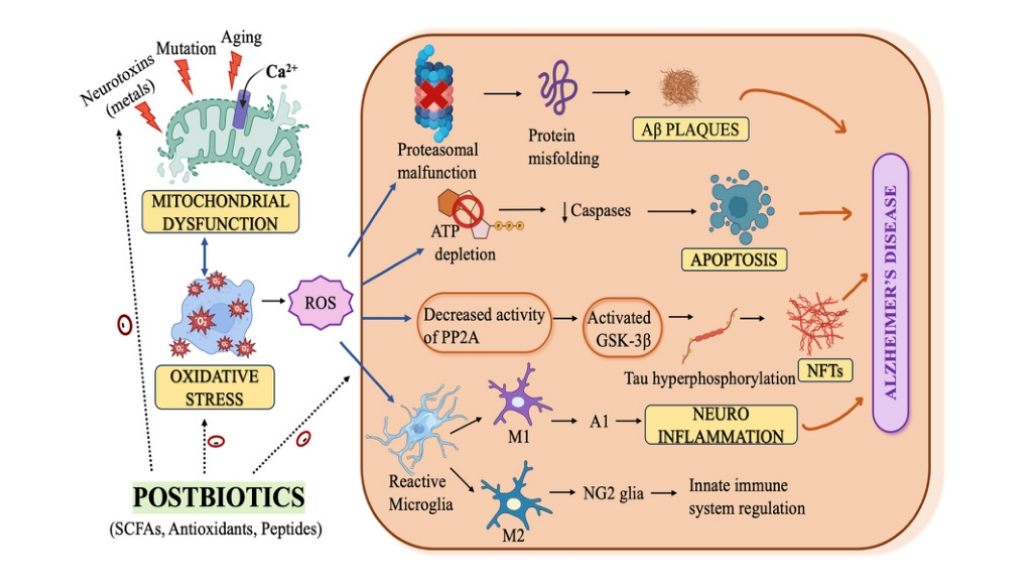
图2 后生元在AD中的线粒体功能障碍、氧化应激和神经炎症中的作用
二、后生元在神经炎症中的调节机制
(1)后生元通过调节小胶质细胞的极化来影响免疫系统。它们将小胶质细胞从促炎症的M1表型(诱导神经毒性A1反应性星形胶质细胞)转变为抗炎症的M2表型,促进神经保护和组织修复。这种转变也刺激了NG2(也称为少突胶质细胞前体细胞)的分化,进一步有助于减少神经炎症。
(2)后生元通过抑制活化B细胞的核因子kappa轻链增强子(NF-κB)炎症通路来降低TNF-α和IL-6的表达,从而减少炎症。
三、后生元与淀粉样β蛋白的相互作用:揭示病理标志
(1)短链脂肪酸(如丁酸盐)通过调节多种途径(如阻断β和γ-分泌酶的信号通路)在AD中发挥神经保护作用,从而减少Aβ的产生和积累。此外,短链脂肪酸还能增强与突触可塑性和神经营养因子相关的基因表达,这些因子对神经元存活和认知功能至关重要。
(2)短链脂肪酸还能抑制ApoE4的表达,ApoE4是AD的遗传风险因素,进一步减轻神经退行性病变。
(3)短链脂肪酸还能促进小胶质细胞的吞噬作用,清除大脑中的Aβ斑块。它们还能调节小胶质细胞和星形胶质细胞的活性,减少促炎细胞因子的分泌,如IL-1α和TNF-α,从而减轻神经炎症。
(4)丁酸盐和其他短链脂肪酸可以减少Aβ聚集,通过抑制组蛋白去乙酰化酶(hdac)的活性来减缓老年斑的发展。
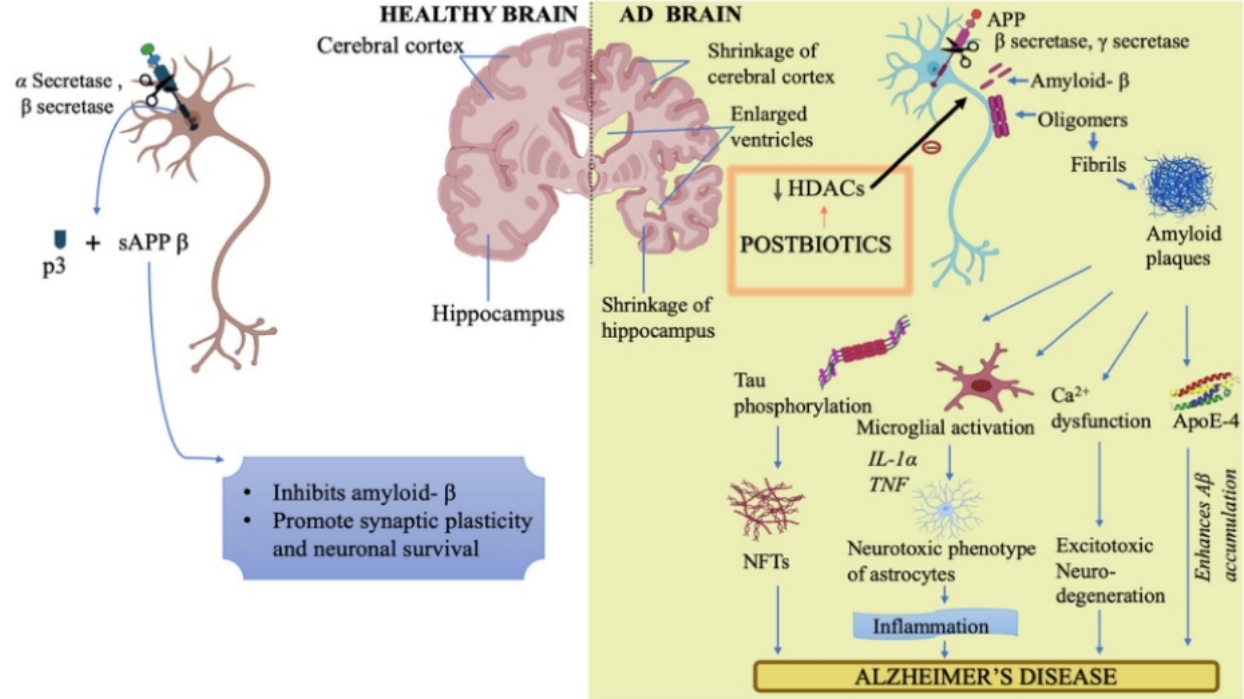
图3 后生元在阿尔茨海默病中Aβ的作用
四、后生元与tau蛋白的相互作用:对分子机制的深入探讨
(1)后生元可以降低氧化应激,从而减少糖原合成酶激酶-3β(GSK-3β)的过度活跃并保护神经元。
(2)后生元可以通过剂通过磷脂酰肌醇-3激酶/蛋白激酶B (PI3K/Akt)信号通路降低GSK-3β和tau的磷酸化过程。
(3)后生元可能影响控制GSK-3β表达的表观遗传变量,进而帮助维持较低的GSK-3β水平。
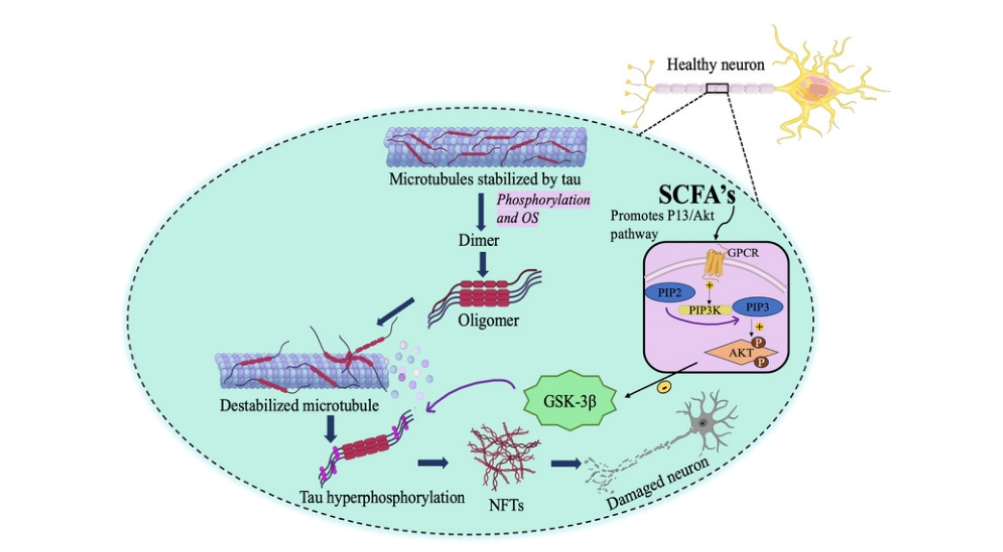
图4 后生元在调节AD中tau磷酸化中的作用
五、后生元与神经递质:关于神经炎症的分子见解
(1)后生元通过调节5-HT(血清素)介导的色氨酸代谢途径,减少神经毒性代谢物(如喹啉酸)的产生,促进血清素合成以保护神经元免受兴奋性毒性和炎症损伤。
(2)植物乳植杆菌(Lactiplantibacillus plantarum)、空肠弯曲菌(Campylobacter jejuni)、普通拟杆菌(Bacteroides vulgatus)及其代谢产物乙酸可通过迷走神经增加大脑谷氨酸水平,参与肠道到大脑的感官信号传递。
(3)短双歧杆菌长亚种(Bifidobacterium longum subsp. longum)、长双歧杆菌(Bifidobacterium longum)、短双歧杆菌婴儿亚种(Bifidobacterium longum subsp. infantis)等后生元通过调节谷氨酸转运蛋白(如GLT-1、GLAST),维持谷氨酸稳态,防止兴奋性毒性导致的神经元损伤。
(4)后生元通过G蛋白偶联受体(如GPR43)调控神经递质(包括乙酰胆碱、GABA、谷氨酸)的释放与平衡,支持突触可塑性及认知功能。
/ 总 结
文章总结指出,后生元可能是一种治疗AD的新兴策略,具有广阔的应用前景。强调了后生元在调节AD关键病理特征方面的诸多作用,包括氧化应激、线粒体功能障碍、神经炎症和谷氨酸兴奋性毒性等。这些机制对于延缓AD进展和减轻其神经退行性影响至关重要。此外,强调了肠道菌群失调与AD发病机制之间的显著相互作用。肠道菌群组成的改变导致有害代谢物的产生,包括有毒和错误折叠的蛋白质,这些蛋白质有助于突触丢失、认知下降和神经元损伤。后生元通过恢复肠道菌群平衡,可提供一种靶向方法来减轻这些有害影响。后生元的治疗效果,加上其最小的副作用,突显了后生元在AD中的治疗潜力,值得进一步探索。
文献来源:Hunjan G ,Aran R K .Postbiotics as a Therapeutic Tool in Alzheimer's Disease: Insights into Molecular Pathways and Neuroprotective Effects.[J].Ageing research reviews,2025,106102685. DOI:10.1016/J.ARR.2025.102685


 上一篇:揭秘丨幽门螺杆菌 胃部的隐形杀手
上一篇:揭秘丨幽门螺杆菌 胃部的隐形杀手 相关新闻
相关新闻
 2026-02-25
2026-02-25


















